2025 年 4 月 23 日,武汉大学张先正团队在Nature Nanotechnology期刊上在线发表了一篇题为“An orally administered gene editing nanoparticle boosts chemo-immunotherapy in colorectal cancer”的研究成果。
该研究显示,敲除肿瘤细胞中的 TRAP1 基因能够有效促进亲环素D(CypD)的线粒体膜易位,导致线粒体膜孔的持续开放,并引发下游炎症反应。这种线粒体通透性的改变进一步增强了化疗药物诱导的肿瘤细胞坏死,显著提高了结肠癌部位的免疫浸润。基于此,研究团队创新构建了具有肠道黏液快速穿透能力的口服 CRISPR/Cas9 递送系统(HTPBD),该纳米载体通过转胞吞作用实现肿瘤组织的高效靶向富集。在多种结肠癌模型中,HTPBD 介导的基因编辑治疗与化学免疫疗法产生协同增效作用,显著提升了治疗效果。
论文通讯作者是张先正;第一作者是赵锴。
虽然免疫检查点阻断疗法(ICB)近年来取得显著进展,但约 85% 的结肠癌属于微卫星稳定型(MSS),导致现有 ICB 疗法对多数患者应答有限。最新研究表明,化疗诱导的免疫原性死亡(ICD)可增强肿瘤部位免疫浸润,已被纳入 ICB 联合治疗方案以提高免疫治疗应答率。然而,当前联合疗法存在显著个体差异,化疗耐药性常导致疗效欠佳。
线粒体应激作为化疗耐药的重要机制,涉及多种线粒体蛋白调控。研究发现,线粒体 CypD 蛋白与多种炎症性疾病相关,但在结肠癌中,TRAP1 蛋白的高表达会与其形成复合物,阻碍 CypD 膜易位及下游炎症反应。抑制 TRAP1 可促进 CypD 介导的线粒体通透性转变(MPT)驱动型坏死,从而增强化疗后炎症反应,这为化疗强化提供了新策略。然而现有 TRAP1 抑制剂存在线粒体积累不足、选择性差、药代动力学不理想等缺陷。相比之下,CRISPR/Cas9 系统具有短期给药、长效调控的优势,结合结直肠癌患者更易接受的口服给药方式,发展口服 CRISPR 递送系统具有重要临床价值。
鉴于此,张先正团队证实了结肠癌特异性高表达的 TRAP1 蛋白在被敲除后,可有效诱导 CypD 膜易位,显著增强化疗后的肿瘤坏死和免疫浸润。研究团队通过合成与筛选最佳比例的多糖-两性离子聚合物(HA-TMAO),成功构建口服基因编辑递送系统 HTPBD。该系统不仅能有效保护基因免受胃肠道环境破坏,还具备良好的冻干制剂适应性,有利于长期贮存运输。在动物水平上,HTPBD 可快速穿透黏液屏障,并通过 OCTN2 转运体介导的转胞吞作用靶向富集于结肠癌组织。在多种结肠癌模型中,HTPBD 成功重塑化疗后的免疫活化微环境,展现出显著的肿瘤抑制效果,并显著提升化学免疫联合疗法的治疗效果。
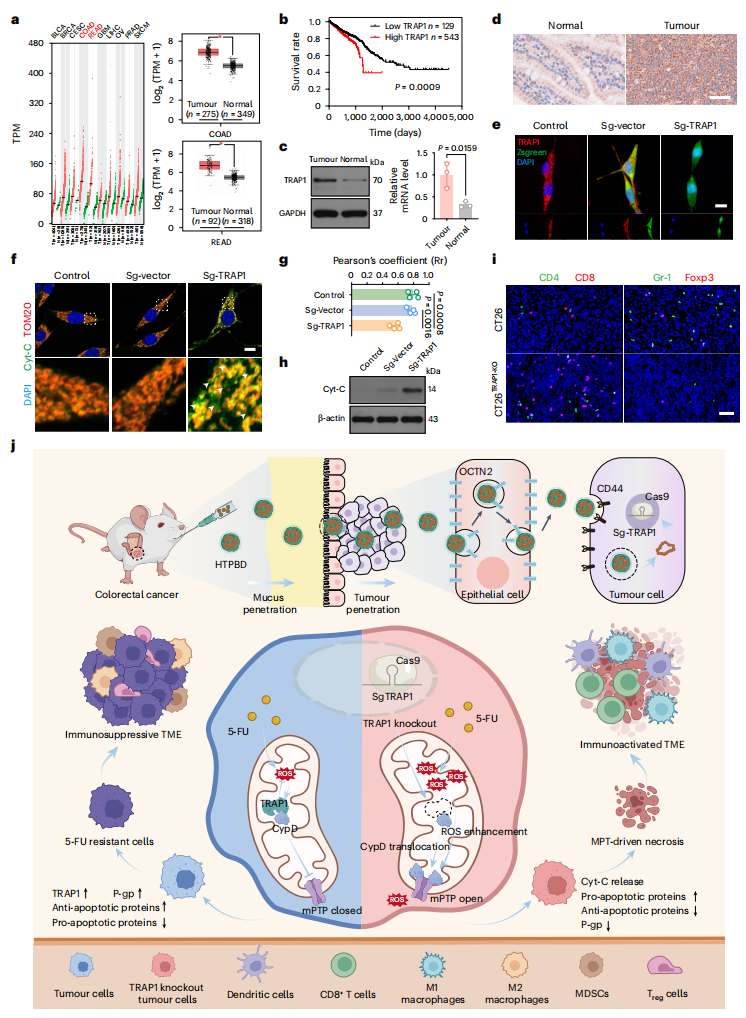
图1:TRAP1 在结直肠癌组织中的特异性表达及其与 MPT 的关联。
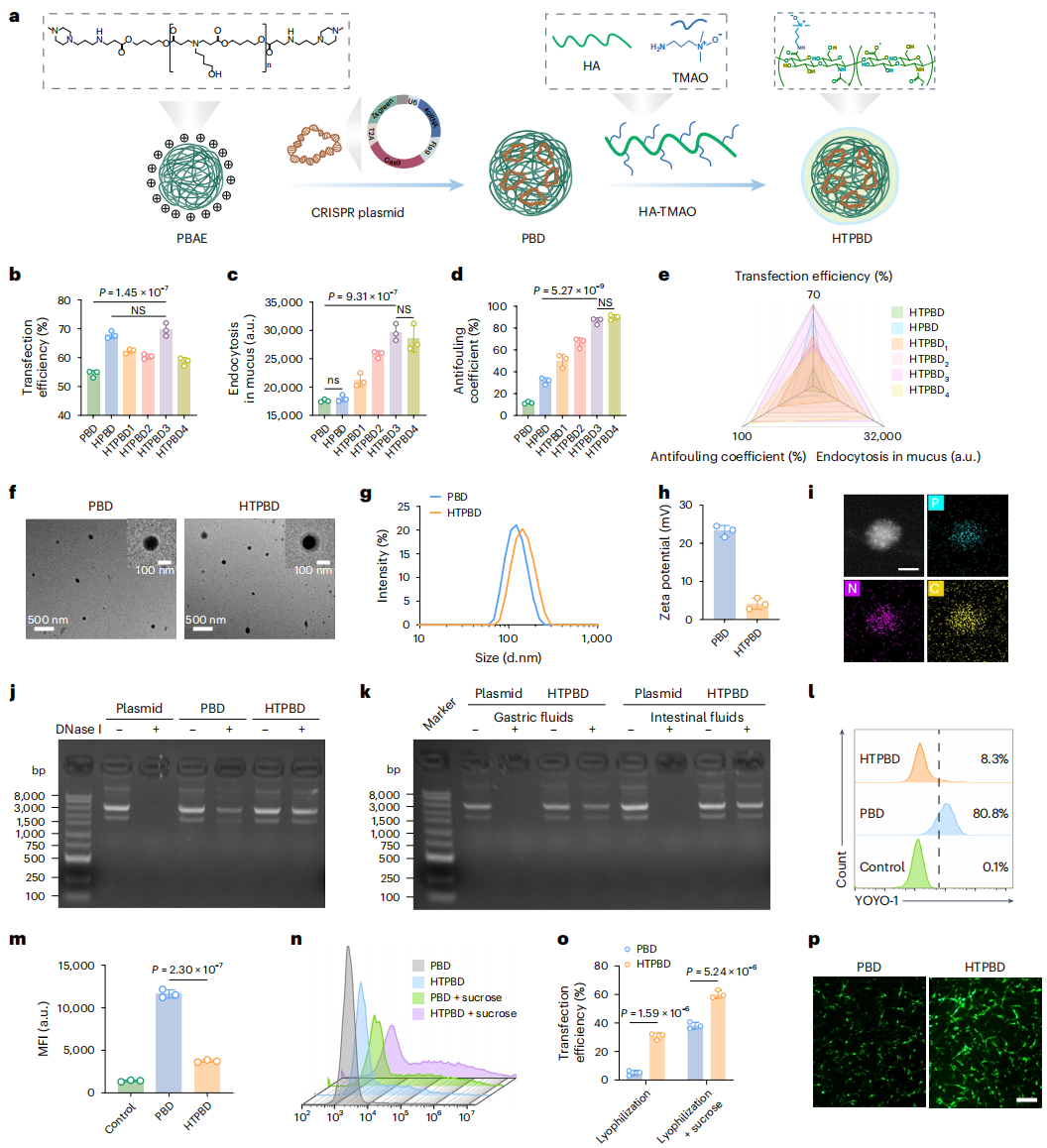
图2:HTPBD 的制备与表征。
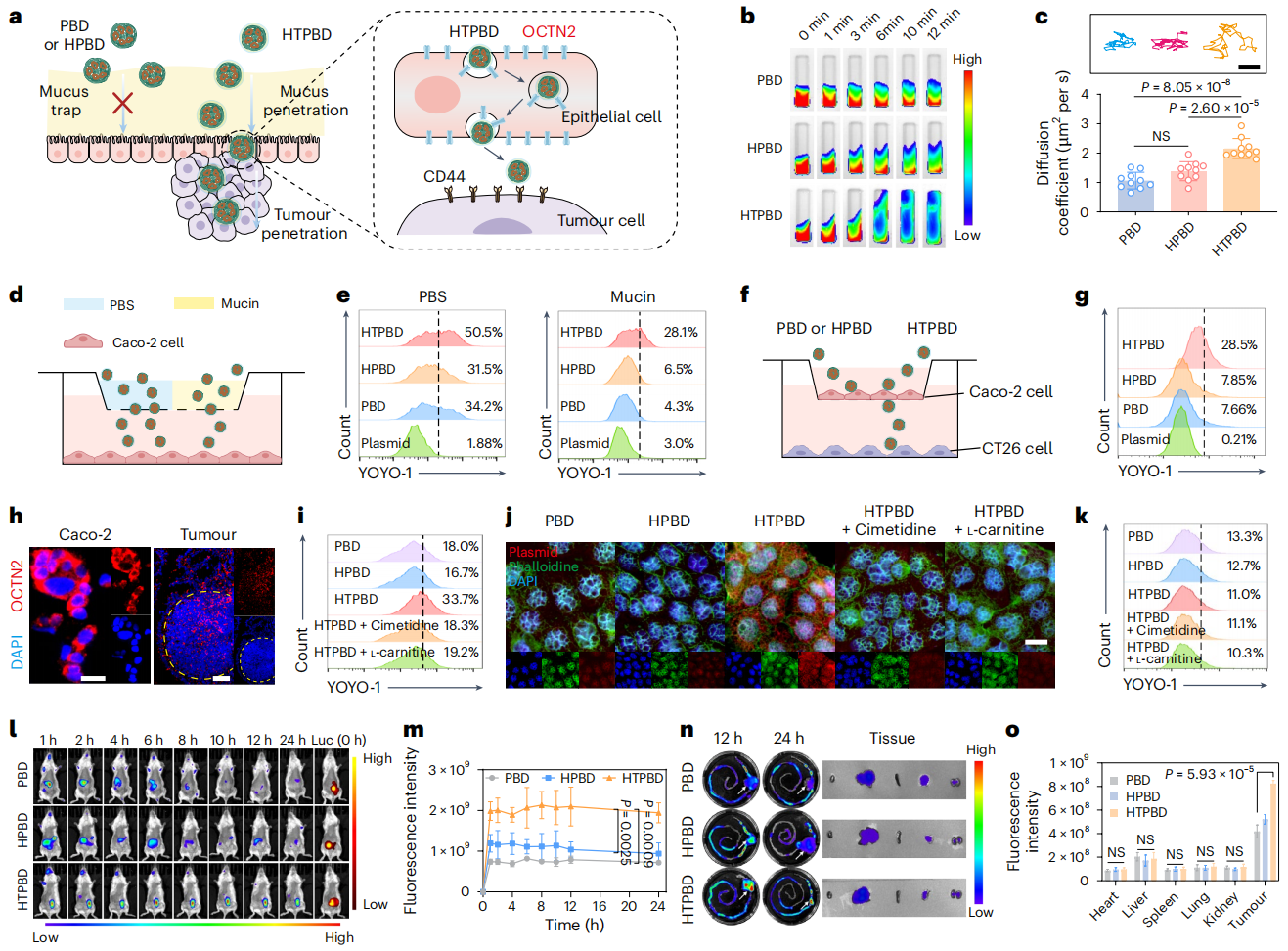
图3:HTPBD 通过粘液穿透和转胞吞作用在肿瘤部位富集。
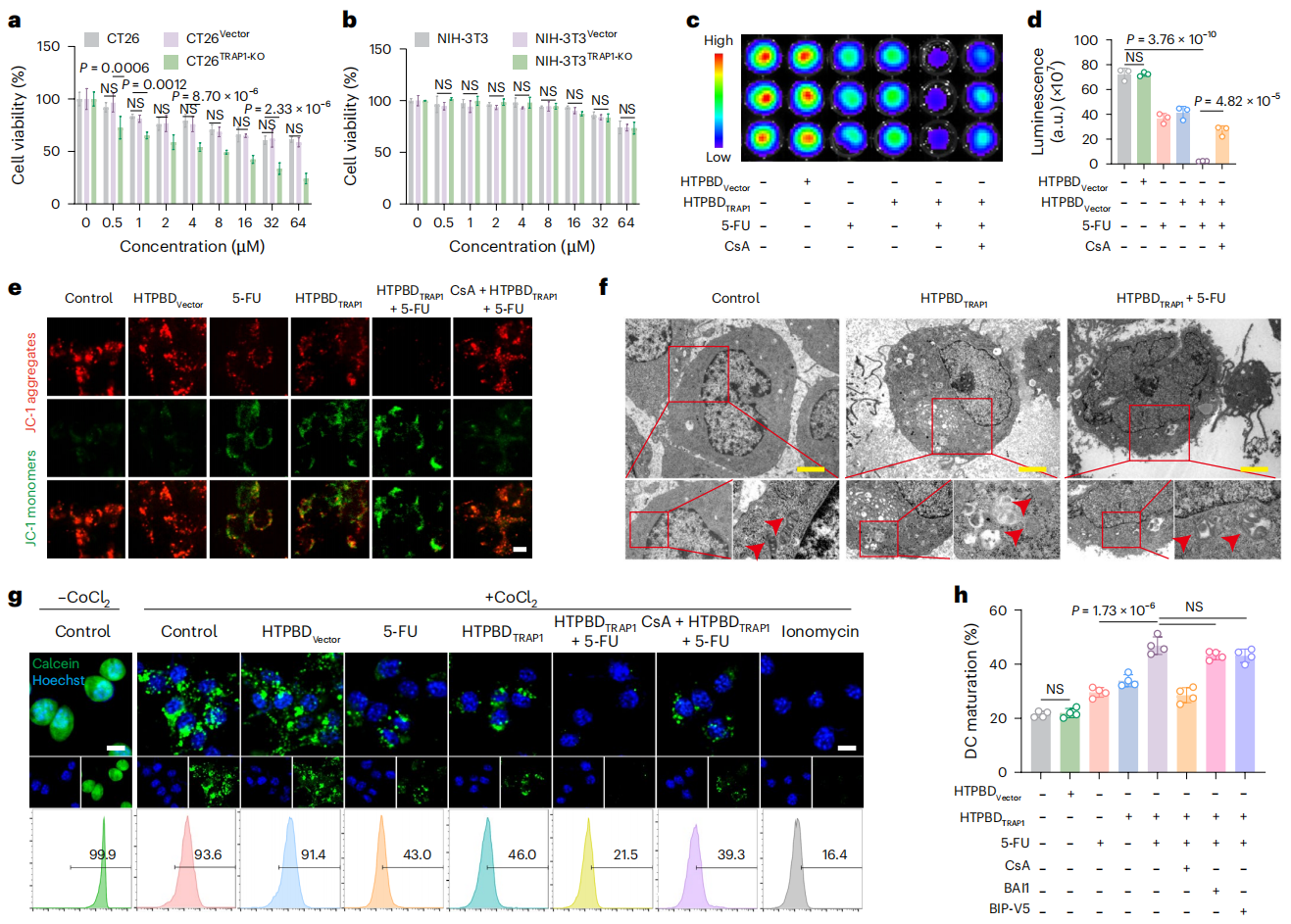
图4:HTPBD 通过 MPT 增强化疗诱导的肿瘤细胞坏死。
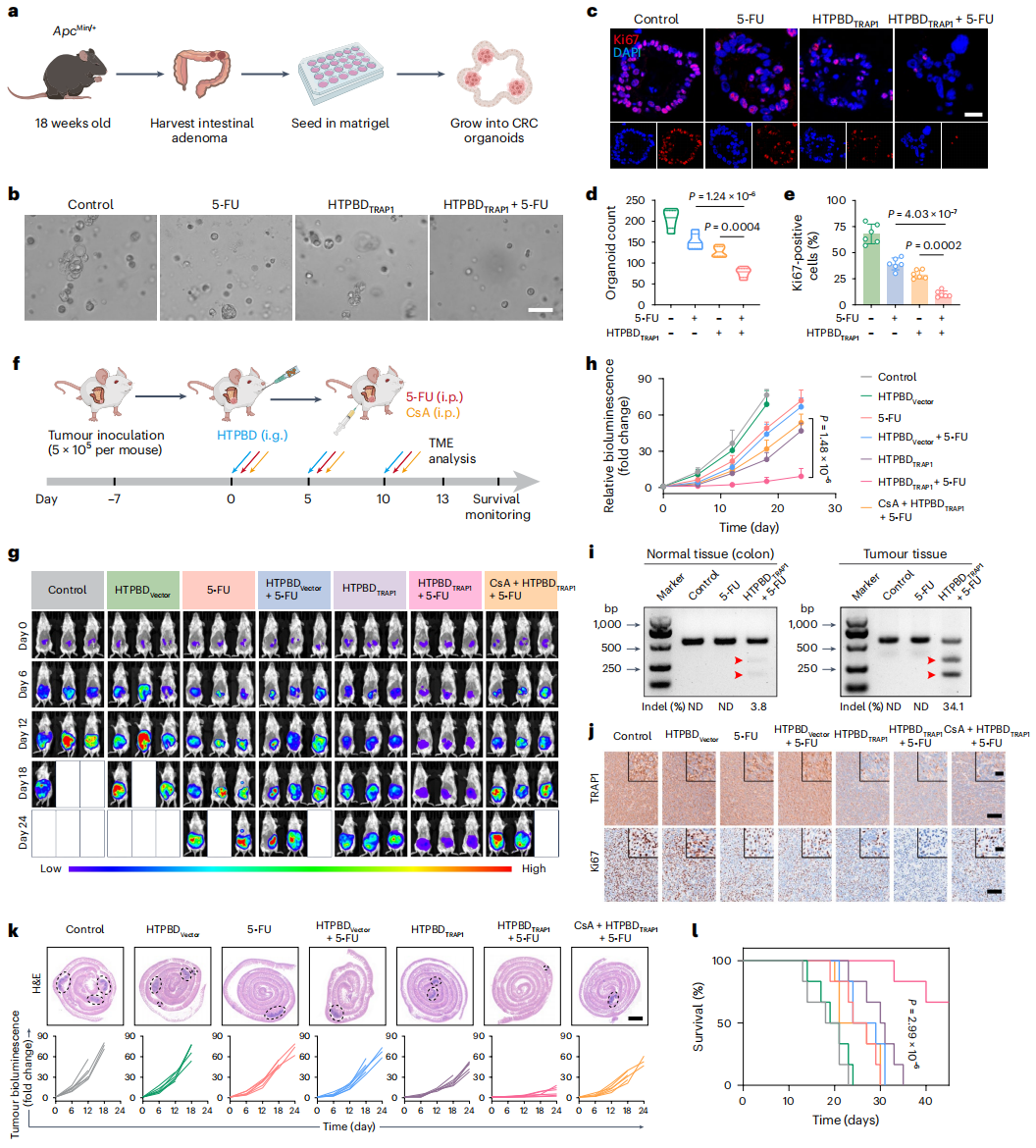
图5:HTPBD 在结肠癌类器官和原位结肠癌模型中增效了化疗。
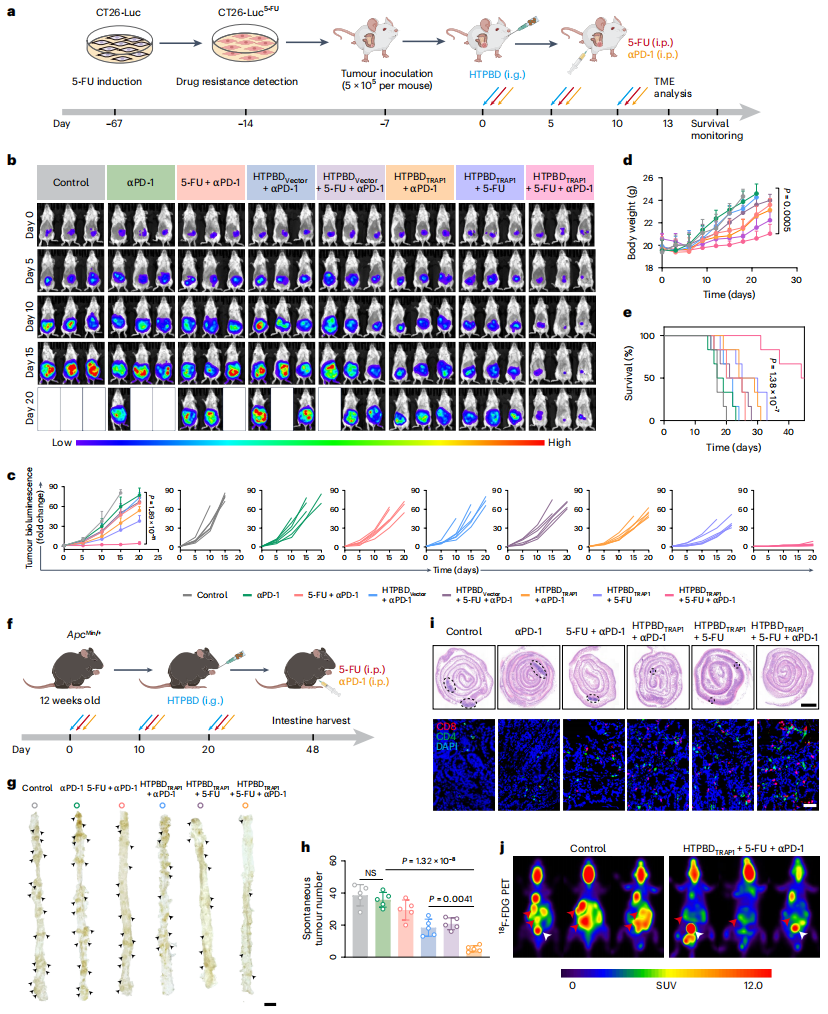
图6:HTPBD 在耐药和自发性结肠癌模型中增效了化学免疫疗法。
该研究创新性地提出口服 CRISPR 递送系统介导的 MPT 增敏策略,通过激活线粒体通路协同化学免疫疗法,为临床治疗消化道“冷肿瘤”提供了突破性的联合治疗方案,具有重要的临床转化价值。(来源:科学网)






